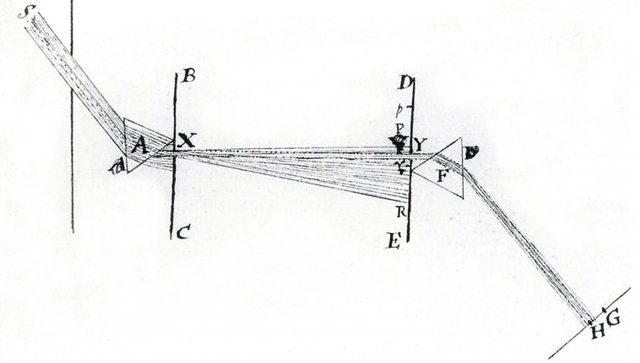
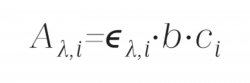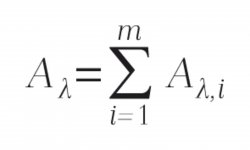Když v roce 1672 sir Isaac Newton publikoval sérii experimentů [1], ve kterých lámal pomocí optického hranolu bílé světlo na jednotlivé složky a následně je skládal zpět, jistě netušil, že otevírá cestu mj. k vysoce účinné metodě v oblasti chemické analýzy látek. Newtonova (korpuskulární) teorie, chápající světlo jako proud částic, byla v 19. století nahrazena teorií vlnovou a ve 20. století teorií duální, která chápe světlo a obecně elektromagnetické záření i jako vlny, i jako částice. To, jak se v konkrétním případě jeví, závisí na úhlu pohledu, to znamená na uspořádání experimentu. Nicméně rozkládání elektromagnetického záření na jeho jednotlivé složky – vlnové délky – se využívá stále. Jen se místo hranolů používají difrakční mřížky, které vynalezl a popsal Joseph von Fraunhofer.
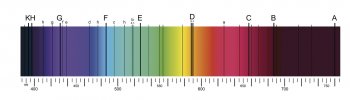
Fraunhofer zároveň vytvořil stupnici vlnové délky a definoval Fraunhoferovy čáry [2], čímž otevřel cestu pro pozorování spekter různých světel a plamenů. Pomocí spektroskopie plamene tak mohli v dvacátých letech 18. století John Herschel a William H. F. Talbot uskutečnit systematické pozorování solí. Nedlouho poté, v roce 1835, zjistil Charles Wheatstone [3], že jednotlivé kovy mohou být snadno rozlišeny pomocí emisních spekter, chcete-li barev, které jejich jiskry vyzařují a které identifikujeme po rozkladu světla jisker spektrometrem. V roce 1849 pak J. B. L. Foucault experimentálně demonstroval, že vlnové délky, které horký materiál vyzařuje (odborně řečeno emisní čáry podle toho, že se tyto vlny zobrazují jako čáry na výstupním grafu), jsou totožné s délkami (čarami), jež pohlcuje [2]. Například rozžhavený sodík vyzařuje ve světle sodíkového oblouku čáru D, což je elektgromagnetická vlna, kterou jiný sodík, vystavený tomuto záření, pohlcuje. Skutečnost, že daná látka (např. sodík) emituje tytéž elmg. vlny, které absorbuje, plyne ze zákona zachování energie.
Systematické zkoumání spekter jednotlivých chemických prvků a sloučenin začal v roce 1860 německý fyzik Gustav Kirchhoff spolu s kolegou chemikem Robertem Bunsenem. Na základě mnoha měření se jim povedlo objevit vazbu mezi chemickými prvky a jejich jedinečnými spektrálními vzory. Oba vytvořily techniku <0x200B><0x200B>analytické spektroskopie a následně zveřejnili spektra osmi prvků včetně identifikace jejich přítomnosti v několika „přírodních látkách” [4].
Teorie
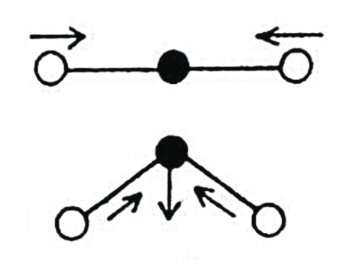
Jedním z hlavních konceptů spektroskopie je rezonance a její odpovídající rezonanční frekvence. Rezonance byla nejprve popsána u jednoduchých vibrujících nebo oscilujících mechanických systémů – například kyvadel – u kterých se ukázalo, že velikost amplitudy (výchylky krajních poloh), je závislá na frekvenci, kterou systém rozpohybováváme. Zobrazíme-li graf závislosti amplitudy na hybné frekvenci, zjistíme, že při určité hodnotě – rezonanční frekvenci – je amplituda maximální. Krásným příkladem z praxe je houpačka (kyvadlo), kterou dokážeme rozhoupat jen jedinou frekvenci, kterou se dokáže houpat (říkáme jí vlastní frekvence). Pokud chceme, aby se houpačka houpala jinak (s jinou frekvencí), musíme do ní posadit těžší nebo lehčí dítě. Pokud se frekvence vnějšího působení shoduje s vlastní frekvencí oscilátoru, dojde k rezonanci a k zvětšení amplitudy kmitů.
V kvantové mechanice se využívá toho, že atomy a molekuly nejsou uvnitř nehybné, nýbrž oscilují (vibrují, rotují) kolem stacionárních stavů. Ozáříme-li je elektromagnetickým vlněním o rezonanční frekvenci, docílíme zvýšení amplitudy (zesílení kmitů), přesněji řečeno přechodu do vyššího energetického stavu. Z dopadajícího světelného toku tedy některé fotony projdou, jiné se odrazí a rezonující část je pohlcena vazbami uvnitř vzorku.
Techniky měření
Spektrometrem lze měřit jak zeslabení zářivého toku po průchodu záření vzorkem (transmisní měření), tak i odražené záření (reflexní měření). V rámci reflexních technik se nejčastěji uplatňuje princip difúzní reflexe, kdy se dopadající záření odráží od povrchu jednotlivých malých částic práškového vzorku. Transmisní měření se využívá především v případě kapalin, kašovitých vzorků a polymerních folií [7].
Infračervené záření, které v spektrometrech používáme, se dělí dle vlnové délky na 3 podskupiny:
- blízká IČ oblast (Near Infrared, NIR): 12 500–5 000 cm-1
- střední IČ oblast (Mid Infrared, MIR): 5 000–500 cm-1
- vzdálená IČ oblast (Far Infrared, FIR): 500–10 cm-1
Jako zdroje záření slouží keramické tyčinky vyhřívané na vysokou teplotu (zhruba 1 500 °C), např. z karbidu křemíku (Globar) nebo směsi oxidů vzácných zemin – Nernstova tyčinka (zirkon, yttrium a erbium) či lasery. V oblasti NIR se používají Wolframové nebo Wolfram-halogenové žárovky, v MIR pak vysokotlaké Hg výbojky. Detektory většinou pracují na základě měření tepelných účinků dopadajícího infračerveného záření.
NIR spektrometrie
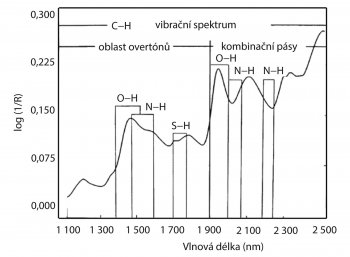
Jak již bylo řečeno, každá molekula je schopna absorbovat elektromagnetické záření a jeho energii měnit ho na vibrace s rotacemi, kdy kromě základních frekvencí lze ve spektrech pozorovat vibrace s násobným vlnočtem (harmonické) a vibrace součtové (kombinační). Odtud vyplývá, že molekula se ve skutečnosti chová jako anharmonický oscilátor. Vibrace polyatomové molekuly si lze představit jako soubor vibrací řady oscilátorů, jejichž pohyby jsou na sebe vázány a vzájemně se ovlivňují [6].
Při vyhodnocování se ve spektroskopii obecně vychází z platnosti Lambertova-Beerova zákona, kdy pro každou jednotlivou složku i směsného vzorku platí následující vztah:
kde Aλ,i je příspěvek i-té složky k celkové absorbanci Aλ při dané vlnové délce λ, ελ,i je molární absorpční koeficient i-té složky při dané vlnové délce λ, b je optická tloušťka absorbujícího prostředí, ci je koncentrace i-té složky ve směsi.
Celková absorbance Aλ při dané vlnové délce λ je pak součtem příspěvků od všech m nezávislých složek zkoumaného systému:
Vzhledem k tomu, že pásy v NIR oblasti jsou obvykle široké i pro čisté látky a dále že nelze vyloučit překryvy pásů různých složek a vzájemné vlivy měnících se koncentrací jednotlivých složek na tvar příslušných absorpčních pásů, není v této metodě jednoduchý princip Lambertova-Beerova zákona obvykle splněn [7]. Pro kalibraci je tedy třeba vyvíjet kalibrační modely s využitím pokročilých chemometrických algoritmů s využitím rozsáhlé sady vzorků (běžně více jak 30). O kalibrační modely, vzorky i vyhodnocení se postará specializovaný chemometrický software, který může být součástí spektrometru a nebo instalován samostatně na PC.
Příklady aplikací v zemědělství
Pomocí spektrometrie lze stanovovat například zastoupení řady látek – vody, dusíku, bílkovin, množství a typ vlákniny, množství tuků, zastoupení minerálů, popela atd. Analyzovat lze celá zrna plodin (pšenice, ječmen, kukuřice, sója, řepka, atd.), sypké i granulované vzorky. Vlastní měření probíhá velice rychle – řádově v jednotkách až desítkách sekund. Z [6] jmenujme konkrétních příkladů:
- Botanické složení porostu – predikce hmotnostních podílů agrobotanických skupin (trávy, jeteloviny, byliny) v dvojkomponentních (vojtěškotrávy) a trojkomponentních směsích.
- Olistění ve šlechtitelských programech trav, jetelovin aj. – stanovení hmotnostní podílu listů ve sklizené píci bez ruční separace stébel a květenství.
- Zastoupení komponent v krmných směsích – stanovení procentuálního zastoupení složek.
- Výživová hodnoty krmiv – stanovení zastoupení a typu bílkovin, vlákniny, tuku atd.
- Zastoupení N, NOx, C, COx, v půdách.
Závěr
Využití spektrální analýzy v zemědělství skýtá obrovský potenciál. Výrobci přístrojů spolu s výzkumníky přinášejí užitečný a silný nástroj, který je navíc – ve srovnání s chemickými rozbory – šetrný k životnímu prostředí. Je dost možné, že tato nová technologie se bude významně podílet na budoucím vývoji celého odvětví.
Literatura:
[1] Burns, Thorburn (1987): Aspects of the development of colorimetric analysis and quantitative molecular spectroscopy in the ultraviolet-visible region
[2] Brand, John C. D. (1995). Lines of Light: The Sources of Dispersive Spectroscopy, 1800 - 1930. Gordon and Breach Publishers
[3] Brian Bowers (2001). Sir Charles Wheatstone FRS: 1802–1875 (2nd ed.), IET
[4] Kirchhoff, G.; Bunsen, R. (1860). Chemische Analyse durch Spectralbeobachtungen
[5] https://en.wikipedia.org/wiki/Spectroscopy
[6] Václav Míka, Alois Kohoutek, Pavel Nerušil: Spektroskopie v blízké infračervené oblasti (NIR)
[7] Michaela Gráfová: Spektrometrie v blízké infračervené oblasti